Профессор раскрыл секреты создания вакцины против коронавируса
- Профессор раскрыл секреты создания вакцины против коронавируса
- Связанные вопросы и ответы
- Как происходит разработка вакцины от коронавируса
- Сколько времени занимает весь процесс создания вакцины
- Какие методы используются при разработке препарата против COVID-19
- Какую роль играют клинические испытания в создании вакцины от коронавируса
- Какие препятствия могут возникнуть на пути создания эффективной вакцины против COVID-19
- Какие гарантии можно дать, что вакцина будет безопасна для людей
- Что отличает вакцину от других методов борьбы с коронавирусом
- Каковы основные этапы испытаний вакцины на людях
- Каким образом будет обеспечен широкий доступ к вакцине после ее создания
- Новости проекта
- Журнал Respiratory Research опубликовал третье исследование эффективности вакцинации
- Журнал BMC Medicine опубликовал результаты исследования эффективности вакцинации
- «Спутник V» защищает от повреждения легких, вызванного штаммами дельта и омикрон
- «Спутник V» защищает от дельта-варианта SARS-CoV-2: результаты независимого исследования
- Почему жители России не хотят прививаться от COVID-19?
- Антон Барчук рассказал об исследованиях ИММИ в подкасте «Хорошая практика»
- Материал по результатам препринта об исследовании эффективности вакцинации опубликован в журнале Science
- Вакцинация защищает пациентов с COVID-19 от госпитализации и тяжелого поражения легких: независимое исследование
Профессор раскрыл секреты создания вакцины против коронавируса
Об эксперте: Павел Волчков — кандидат биологических наук, вирусолог, генетик, заведующий Лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Существует много разных подходов к созданию вакцины от COVID-19. Она может быть вирусной, инактивированной, векторной, на основе нуклеиновых кислот. Какая из них окажется самой эффективной — пока никто точно не знает. Если вы разработчик, то можете выбрать любую и принять участие в большой мировой гонке по созданию долгожданной прививки. А можете, как ученые из МФТИ, сознательно отказаться от возможных бенефитов и неспешно заняться разработкой экспериментальной вакцины нового типа.
Одни из самых популярных на сегодняшний день — это рекомбинантные или векторные вакцины. Они изготавливаются на основе вирусов-носителей или вирусных векторов. Как это работает? Вы берете какие-то вирусные частицы, «вычищаете» из них все патогенные составляющие и на их место вставляете нужные вам элементы — генетический материал вируса, против которого изготавливается вакцина. По такому принципу была создана прививка от вирусного гепатита B или ротавирусной инфекции. И по такому же принципу сегодня многие разработчики создают вакцину от COVID-19. В частности, в России векторную вакцину от коронавируса разработали в НИИ эпидемиологии и микробиологии имени Н.Ф. Гамалеи.
Павел Волчков:
«Чем хорош вирусный вектор? Он способен инфицировать клетки только один раз и не может размножаться в организме человека дальше. Такая особенность делает рекомбинантные вакцины довольно безопасными. При этом в качестве вирусного вектора можно использовать буквально любой вирус из библиотеки человеческих патогенов. Выбор зависит от того, для какого заболевания вы изготавливаете вакцину. Потому что одни вирусы лучше заражают мышцы, другие — легкие, третьи — центральную нервную систему. Например, та же вакцина Центра Гамалеи выполнена на аденовирусном векторе».
Аденовирусы — ДНК-вирусы. Относятся к группе острых респираторных вирусных инфекций (ОРВИ) и характеризуются поражением слизистых оболочек верхних дыхательных путей, конъюнктив, лимфоидной ткани. Большинство аденовирусных инфекций представляют собой легкую форму инфицирования. Существует семь видов аденовирусов человека (от А до G) и 57 серотипов. Подразделение на серотипы связано с различными способами заражения.
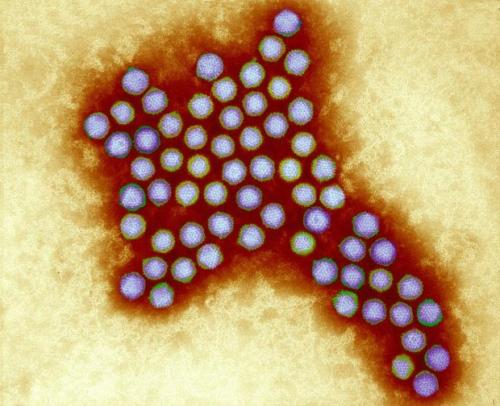
Аденовирус под микроскопом (Фото: Wellcome Images)
В качестве векторов для вакцин, аденовирусы применяются довольно давно. Эти вирусы хорошо изучены. Согласно данным сайта ClinicalTrials.gov , клинические испытания на людях успешно прошли или проходят более сотни различных вакцин на основе аденовирусных векторов.
Среди главных преимуществ этих вирусов — их естественный механизм взаимодействия с клетками человека. Они способны обеспечивать довольно длительную экспрессию антигена, а это успешно активирует врожденный иммунный ответ.
Антигены — это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации, и которые потенциально могут быть распознаны иммунной системой организма.
Павел Волчков:
«При всех плюсах, у аденовирусов есть и ряд минусов. Первое — они обладают провоспалительным эффектом. То есть могут чрезмерно драйвить иммунную систему. Проще говоря — вызывать сильный иммунный ответ. Это один из возможных побочных эффектов вообще всех аденовирусных вакцин. Но есть еще один нюанс. Большинство аденовирусов — это естественные патогены человека. Многие из нас сталкивались в течение жизни с аденовирусными инфекциями. А что это значит? Что в крови у таких людей уже есть нейтрализирующие антитела к этому вирусу. Они могут связываться с компонентами вакцины и блокировать ее действие. Поэтому для некоторых из нас такая вакцина будет совершенно неэффективна».
Связанные вопросы и ответы:
1. Как работает вакцина от коронавируса
Ответ: Вакцина от коронавируса работает путем введения в организм ослабленного или мертвого вируса, либо его части. Это позволяет иммунной системе организма распознать вирус и начать производство антител. Таким образом, при последующем контакте с реальным вирусом организм сможет эффективно бороться с инфекцией.
2. Каковы основные этапы разработки вакцины от коронавируса
Ответ: Основными этапами разработки вакцины является выбор платформы, на которой будет создана вакцина, проведение предварительных испытаний на животных, клинические испытания на добровольцах, анализ результатов и получение регистрации для массового производства.
3. Какие преимущества имеет вакцина от коронавируса по сравнению с другими методами борьбы с инфекцией
Ответ: Вакцина от коронавируса позволяет активизировать иммунную систему и развить стойкий иммунитет против вируса. Это более эффективный и безопасный метод, по сравнению с постоянным приемом лекарств или прохождением болезни.
4. Как долго длится разработка вакцины от коронавируса
Ответ: Разработка вакцины от коронавируса может занять разное количество времени, в зависимости от выбранной платформы, доступных ресурсов и приоритетов проекта. Обычно этот процесс может занять от нескольких месяцев до нескольких лет.
5. Какие риски сопутствуют разработке вакцины от коронавируса
Ответ: К различным рискам разработки вакцины от коронавируса можно отнести нежелательные побочные эффекты, неэффективность вакцины, трудности с производством и поставкой, а также возможность возникновения новых штаммов вируса.
6. Как происходит тестирование вакцины от коронавируса на людях
Ответ: Тестирование вакцины на людях проходит в несколько фаз. Это начинается с небольших групп добровольцев, где проверяется безопасность и переносимость вакцины. Затем проводятся более массовые клинические испытания для оценки эффективности и безопасности в реальных условиях.
7. Каковы перспективы использования вакцины от коронавируса в мире
Ответ: Использование вакцины от коронавируса может существенно снизить распространение инфекции и смертность от COVID-19. Это позволит вернуться к обычной жизни, открыть границы для путешествий и уменьшить негативное влияние пандемии на экономику и здравоохранение.
Как происходит разработка вакцины от коронавируса
Фармацевтические компании, занимающиеся разработкой лекарственных препаратов и вакцины от коронавируса SARS-CoV-2, используют как классические технологии, так и современные технологические платформы для создания синтетических вакцин (мРНК-вакцины, субъединичные и пептидные вакцины). Подбор технологической платформы (технологии создания вакцины) является чрезвычайно сложным процессом, во многом определяющим дальнейший процесс исследований. Рассмотрим некоторые из технологий.
Классическая технология разработки вакцины
Они могут создаваться как на основе живых ослабленных возбудителей болезни, так и инактивированных возбудителей, а также на основе более современных технологий, включающих в вакцину фрагменты вирусов/бактерий или анатоксины из обработанных специальным образом токсинов возбудителей. Иммунная система организма реагирует на них и при появлении такого же возбудителя она распознает его и нейтрализует.

Прототип вакцины ChAdOx1 nCoV-19
Вакцины такого рода — бактериальная и вирусная вакцина . Представлены препаратами, содержащими микроорганизмы аттенуированные разными типами воздействий на них. Они имеют существенные недостатки в виде: высокого риска реверсии вирулентности, высокой реактогенности, присутствия вирусов-контаминантов и химических инактиваторов, высокого содержания клеточного балласта, что затрудняет осуществление контроля качества при их производстве.
По сути, это технология создания вакцин первого поколения и тем не менее эта технология в рекомбинации с другими современными технологическими приемами продолжает использоваться. Примером такого подхода является прототип вакцины ChAdOx1 nCoV-19 , которая создана на базе ослабленной версии аденовируса у шимпанзе, в которую добавлена часть генетического кода коронавируса или созданных на платформе других вакцин на основе вирусов гриппа А , кори , везикулярного стоматита , вируса Эбола .
Биосинтетические вакцины
Это вакцины второго поколения — белковая вакцина . В своем большинстве представлены рекомбинантными белками, аминокислотными последовательностями структур бактериального и вирусного белка, которые могут распознаваться иммунной системой человека и вызывать адекватный иммунный ответ. Такая рекомбинантная вакцина лишена недостатков вакцинных препаратов первого поколения и вызывают узко специфичный иммунный ответ.
Несмотря на относительно меньшую эффективность вакцин этого поколения в сравнении с исходным вирусом, что обусловлено меньшей иммуногенностью искусственно созданных участков, комбинированное использование нескольких различных иммуногенов позволяет обеспечить высокий/достаточный иммунный ответ при существенном снижении побочного действия вакцины и ее реактогенности, что является существенным конкурентным преимуществом. Примером может служить вакцина, созданная на базе субъединицы S-белка SARS-CoV-2 — S-Trimer с усилителем иммунной реакции (адъюванта). Поскольку такая вакцина вирусного материала не содержит, спектр ее побочных действий чрезвычайно низок
Еще одной технологической платформой является рекомбинантная экспрессия белков, отвечающих за сборку капсида в вирусных/дрожжевых системах. Установлено, что именно плотноупакованная белковая структура поверхности капсомера и опосредует его высокую иммуногенность. Эта технология позволяет получать вирусоподобные частицы (VLP) , объединенные в структуру, близкую к оригинальному вириону. Функциональные физиологические характеристики VLP, сформированные капсидным белком, индуцируют выработку антител класса IgG , что и явилось базой для создания VLP-вакцин. Иммунизация животных вакциной VLP в эксперименте позволила защитить животных от последующего заражения вирусом. Канадская фарм-компания Medicago еще в марте 2020 года заявила о начале производства вирусоподобных частиц (VLP) коронавируса и ими же разрабатывается VLP-вакцина от коронавируса SARS-CoV-2.
Особого внимания заслуживают синтетические вакцины , создаваемые на различных технологических платформах. Одной из таких является транскрипционная технология с использованием синтетических матричных РНК (мРНК). Создаваемая на базе этой технологии мРНК-вакцина осуществляет кодирование белков-антигенов конкретного инфекционного агента, а иммунная система человека реагирует на них выработкой T-клеточного ответа.
Вакцинные препараты на базе мРНК обладают высоким потенциалом стимулирования T-клеточного ответа по сравнению с вирусными инактивированными и белковыми вакцинами. К преимуществам мРНК технологии можно отнести их способность имитировать естественные вирусные патогены, поскольку синтез мРНК-опосредованных антигенных белков вирусного патогена осуществляется непосредственно в клетках организма человека, где и осуществляются посттрансляционные модификации, аналогичные таковым, происходящим при натуральном жизненном цикле вируса, попадающем в организм. То есть, инъекция, содержащая РНК белка коронавируса, вызовет у человека иммунный ответ, при этом, фактически не заразив его полноценным вирусом.

Сколько времени занимает весь процесс создания вакцины
— Существует несколько видов возбудителей болезней: вирусы, бактерии, грибы и паразиты. Сегодня в арсенале врачей есть вакцины против трех разновидностей – противовирусные, противобактериальные, а сейчас появились еще и противопаразитарные.
Бактериальных инфекций, к которым относится и пневмококковая (или streptococcus pneumoniae), на самом деле достаточно много. Чем они отличаются от вирусных инфекций? Препаратов для лечения вирусных инфекций очень мало, и чаще всего единственное средство их предупреждения — вакцинация. Для бактериальных инфекций ситуация иная – есть антибиотики.
Вирус – это примитивный организм, одна из самых древних форм жизни на Земле. По сути, это кусок генетического кода – ДНК или РНК, и его самая главная задача – воспроизводиться. Бактерии – это более сложные организмы, уже вооруженные разными факторами защиты, однако биологическая или эволюционная задача бактерий – тоже самовоспроизводство.
Для пневмококков наиболее правильная эволюционная стратегия – жить в носоглотке, размножаться в этой области, обмениваться ценной генетической информацией с другими бактериями, но при этом не убивать «хозяина». Гибель хозяина для них эволюционно – тупиковый вариант, поскольку так пневмококки не смогут распространиться.
Тем не менее, есть разные виды пневмококка, серотипы, которые, попадая к человеку, ведут себя иначе. Так возникают инвазивные пневмококковые инфекции, они протекают очень тяжело и с высокой угрозой для жизни хозяина.
Инвазия – это проникновение пневмококка за пределы носоглотки, попадание бактерии в исходно стерильные среды организма (кровь, ликвор, плевральную жидкость и т. д.), что может привести к таким тяжелым состояниям, как сепсис, бактериемия, плеврит; или в мозговые оболочки, вызывая пневмококковые менингиты.
Чаще пневмококк вызывает пневмонию (воспаление легких), пневмококковые отиты (воспаление среднего уха), наблюдаются также синуситы, гаймориты, пневмококковые конъюнктивиты (воспаление слизистой оболочки глаз).
Вакциноуправляемых инфекций сегодня становится все больше, поскольку развиваются молекулярная биология и биохимия, появляются новые вакцины. Мы лучше понимаем, как бактерии или вирусы действуют, и можем выбрать механизм противодействия им через обучение организма.
Вакцина – по сути, учитель иммунной системы, своего рода тренировка: когда врач вводит бактериальные или вирусные вещества в организм, иммунная система учится быстро их распознавать и понимать, как с ними надо бороться. Несмотря на то, что такие «учения» могут быть относительно опасны, эксперты отмечают, что и частота, и тяжесть поствакцинных реакций в сотни и в тысячи раз ниже, чем, если бы человек заболел по-настоящему.
В начале XX века вакцины появлялись относительно быстро. Сегодня же этот процесс претерпел значительные изменения, в том числе, в связи с тем, что сейчас требования к безопасности вакцин – самые строгие в сфере фармацевтики. Фазы доклинических и клинических исследований для вакцин очень длительные и обширные по объему – в исследования вакцин включается большее количество людей, чем в испытания других препаратов.
Какие методы используются при разработке препарата против COVID-19
Специалисты предупреждают: не все разработанные в мире вакцины окажутся эффективными. По статистике, до стадии производства доходит не более 6% экспериментальных препаратов.
«Успех экспериментальных вакцин составляет около 7% на доклинической стадии и 15–20% в ходе клинических исследований»,— говорит Сет Беркли, американский эпидемиолог, глава альянса Gavi, пропагандирующего и развивающего вакцинацию (цитата по The Telegraph).
По разным данным, в мире сейчас разрабатывается от 170 до 218 вакцин от COVID-19. ВОЗ 31 июля опубликовала данные о 26 перспективных вакцинах, которые проходят клинические испытания на людях. Большинство нацелено на выработку антител к S-протеину — это такой белковый «шип», которым вирус связывается с рецептором на мембране клетки, в которую затем проникает для размножения. В сущности, благодаря этим «шипам» коронавирус и получил свое название.
По информации ВОЗ, до третьей фазы клинических исследований дошли шесть вакцин :
- Оксфордского университета (совместно с AstraZeneca),
- Американской Moderna (совместно с Национальным институтом аллергии и инфекционных заболеваний США),
- Немецкой BioNTech (совместно с Fosun Pharma и Pfizer),
- Китайской Sinovac,
- Уханьского института вирусологии,
- Пекинского института вирусологии (обе совместно с Sinopharm).
Вакцина от CanSino Biological Inc./Beijing Institute of Biotechnology, которую планируется вводить китайским военнослужащим, пока заканчивает вторую фазу.
Самой перспективной считается оксфордская вакцина.
Это векторная вакцина на основе аденовируса шимпанзе, несущая ген коронавирусного S-белка. Эксперты ВОЗ называют ее главным претендентом. Свои первые результаты ученые Оксфорда опубликовали 20 июля в престижном медицинском журнале The Lancet : испытания на 1077 взрослых добровольцах показали, что вакцина обеспечивает двойную защиту от коронавируса, формируя и антитела, и клеточный иммунитет, которые будут усилены ревакцинацией. Серьезных побочных эффектов не отмечалось, а незначительные легко снимались парацетамолом. По сообщению The Telegraph , для дальнейшей работы Оксфорду и Имперскому колледжу Лондона, который разработал собственную вакцину от COVID-19, выделили £84 млн.
AstraZeneca еще в мае объявила о контракте на $1,2 млрд с правительством США на поставку 400 млн доз тогда даже не проверенной оксфордской вакцины, а 13 июня подписала соглашение с Евросоюзом тоже на 400 млн доз. Британское правительство согласилось оплатить 100 млн доз, рассчитывая, что 30 млн из них будут доступны жителям Соединенного Королевства уже в сентябре.
Несмотря на обнадеживающие данные, некоторые источники The Telegraph подчеркивают, что факт обеспечения долговременного иммунитета оксфордской вакциной еще не доказан. На это как раз и направлена третья фаза клинических испытаний.
Профессор Адриан Хилл, директор Института Дженнера при Оксфордском университете и один из разработчиков вакцины
Все готовы инвестировать в ее производство еще до окончания клинических исследований. Это, конечно, лестно, но не гарантирует результат. Она может провалиться, может выстрелить, а может оказаться середнячком».
Вакцина, разработанная совместно немецкой биотехнологической BioNTech и фармацевтической Pfizer, использует вирусную РНК. Первые данные исследований показали ее безопасность и способность в больших количествах генерировать антитела к SARS-CoV-2. О клеточном иммунитете информации нет.
По вакцине Moderna в медицинском издании The New England Journal of Medicine было опубликовано несколько отчетов, в том числе о ее действии на макак-резус и людей. В качестве транспорта, доставляющего вакцину в организм, здесь используются липидные наночастицы; они содержат матричную РНК коронавирусного S-протеина.
Если верить опубликованным результатам, вакцина способствует выработке количества антител, превышающего их содержание у переболевших COVID-19.
Но после повторного введения вакцины у 21% испытуемых в группе с дозой 250 мкг были отмечены серьезные побочные эффекты. Третья фаза испытаний стартовала 27 июля, и министр здравоохранения США Алекс Азар весьма оптимистичен: «Благодаря руководству президента Трампа и упорному труду американских ученых вакцина, разработанная Национальными институтами здравоохранения и компанией Moderna, подошла к третьей фазе испытаний в рекордные сроки».
Китайская биотехнологическая Sinovac тоже сообщила о положительных результатах испытаний вакцины, использующей инактивированный SARS-CoV-2. Третья фаза исследования проходит в Бразилии с участием 8870 добровольцев. Предусмотрена вакцинация в два этапа с интервалом 14 дней.
Какую роль играют клинические испытания в создании вакцины от коронавируса
Русский научный журнал "Вестник новых медицинских технологий" опубликовал статью "О механизме действия современных иммунобиологических препаратов" . В ней впервые – со страниц выходящего в России официального научного издания – говорится об опасности применения препаратов для профилактики COVID-19, которые во всём мире и в России называются вакцинами. Авторы научной статьи – доктор медицинских наук профессор Александр Редько и доктор медицинских наук профессор Денис Иванов – фактически опровергают официальную позицию Минздрава России относительно необходимости вакцинации против коронавируса.
Важно отметить, что издание, опубликовавшее эту статью, входит в перечень ВАК, представлено в Научной электронной библиотеке – головном исполнителе проекта по созданию Российского индекса научного цитирования, а также в Semantic Scholar, Google Scholar, КиберЛенинке.
Цель исследования Редько и Иванова заключалась в том, чтобы "провести анализ опубликованных данных, посвящённых механизму действия препаратов для профилактики новой коронавирусной инфекции". Авторы ознакомились с доступной медицинской литературой в поисковых базах e-library, PubMed и многих других изданиях. По данным русского исследования, на эту тему вышло уже 34 тысячи научных работ. Наибольшее количество подобных научных публикаций приходится на 2022 год – более 18,5 тысячи работ. Был отмечен тренд на увеличение соответствующих научных работ , и "ожидать его снижения в ближайшие годы вряд ли придётся" .
Какие препятствия могут возникнуть на пути создания эффективной вакцины против COVID-19
Судебная практика по возмещениям вреда от поствакцинальных осложнений единична. Размер компенсаций низкий. Удалось найти только несколько дел, где суды отказывали в компенсациях из-за недоказанности причинно-следственной связи между прививкой и последствиями.

Решений в пользу истцов по искам о последствиях вакцинации немного, и зачастую они связаны с нарушением порядка оказания медпомощи при вакцинации, а не с непосредственным вредом влияния вакцины на организм человека.
Генеральный директор «Факультета медицинского права» Полина Габай
В других спорах возникает вопрос о том, является ли вакцинация источником повышенной опасности, то есть взыскивается ли компенсация вреда независимо от вины работников медицинского учреждения.
Есть пример, когда деньги присудили. Мать ребенка, который страдал поствакцинальным оститом, взыскала с родильного дома Анапы 300 000 руб. компенсации морального вреда в 2011 году. Самое важное – в заседании подтвердилось, что между осложнением и прививкой была причинно-следственная связь. И хотя процедура была сделана правильно, Анапский городской суд принял решение в пользу матери. Он обосновал свой выбор тем, что назначение медицинских препаратов – это сфера повышенной опасности, а значит, не имеет значения, виноваты врачи или нет. Решение по делу № 2-98/2011 устояло в апелляции.
Есть и отрицательная практика. Похожее дело матери ребенка против Волгоградского роддома дошло до Верховного суда, правда, отмена была по процессуальным основаниям (№ 2-КГ 13-4 ). А решение по существу вынес в 2013 году Вологодский областной суд . Он отказал в компенсации морального вреда, ведь вина сотрудников роддома не подтверждена. Ее надо доказывать. Ведь вакцинация не является сферой повышенной опасности, а врачебная деятельность для того и нужна, чтобы сохранять жизнь и здоровье человека, решила апелляция. Она напомнила о компенсациях, которые предусматривает закон «Об иммунопрофилактике инфекционных болезней».
Судебная практика по возмещению вреда от поствакцинальных осложнений единична. Размер компенсаций низкий. Удалось найти только несколько дел, где суды отказывали в компенсациях из-за недоказанности причинно-следственной связи между прививкой и последствиями.
Решений в пользу истцов по искам о последствиях вакцинации немного, и зачастую они связаны с нарушением порядка оказания медпомощи при вакцинации, а не с непосредственным вредом влияния вакцины на организм человека.
Генеральный директор «Факультета медицинского права» Полина Габай подчеркнула, что в других спорах возникает вопрос о том, является ли вакцинация источником повышенной опасности, то есть взыскивается ли компенсация вреда независимо от вины работников медицинского учреждения.
Примеры судебных решений
Есть пример, когда деньги присудили. Мать ребенка, который страдал поствакцинальным оститом, взыскала с родильного дома Анапы 300 000 руб. компенсации морального вреда в 2011 году. Самое важное – в заседании подтвердилось, что между осложнением и прививкой была причинно-следственная связь. И aunque процедура была сделана правильно, Анапский городской суд принял решение в пользу матери. Он обосновал свой выбор тем, что назначение медицинских препаратов – это сфера повышенной опасности, а значит, не имеет значения, виноваты врачи или нет. Решение по делу № 2-98/2011 устояло в апелляции.
Есть и отрицательная практика. Похожее дело матери ребенка против Волгоградского роддома дошло до Верховного суда, правда, отмена была по процессуальным основаниям (№ 2-КГ 13-4 ). А решение по существу вынес в 2013 году Вологодский областной суд. Он отказал в компенсации морального вреда, ведь вина сотрудников роддома не подтверждена. Ее надо доказывать. Ведь вакцинация не является сферой повышенной опасности, а врачебная деятельность для того и нужна, чтобы сохранять жизнь и здоровье человека, решила апелляция. Она напомнила о компенсациях, которые предусматривает закон «Об иммунопрофилактике инфекционных болезней».
Какие гарантии можно дать, что вакцина будет безопасна для людей
В настоящее время применяются несколько различных типов потенциальных вакцин против COVID-19, в том числе:
- Инактивированные или ослабленные вирусные вакцины с использованием вируса, который был инактивирован или ослаблен и не вызывает болезни, но при этом генерирует иммунный ответ (вакцина от компании Sinopharm).
- Вакцины на основе белка с использованием безвредных фрагментов белка или содержащей белок скорлупы, имитирующих вирус COVID-19, для безопасного иммунного ответа. "ЭпиВакКорона" — пример такой вакцины.
- Вирусные векторные вакцины с использованием генетически модифицированного вируса, который не может вызывать болезни, но производит белки коронавируса, способные безопасно генерировать иммунный ответ. К таким вакцинам относится "Спутник V" (Гам-Ковид-Вак).
- РНК-вакцины и ДНК-вакцины — передовой подход, использующий генетически модифицированные РНК или ДНК для создания белка, который безопасно вызывает иммунный ответ (вакцины от компаний Pfizer и Moderna, пока не зарегистрированы в России).
Как создаётся «Спутник V»
После вакцинации эффект наступает примерно через три недели. Вакцина "ЭпиВакКорона" переносится незначительно легче, чем "Спутник V", но принципиальных отличий нет. Преимущества вакцин от COVID-19: в целом хорошая переносимость, отсутствие тяжёлых побочных эффектов и хороший иммунный ответ у большинства привитых. Недостатком можно назвать лишь неопределённый период действия появившегося иммунитета после вакцинации.
Вакцина "Спутник лайт" является обычным "Спутником", только с одной дозой вакцины, эффективность её значительно ниже. Она позволяет получить иммунитет немного быстрее, возможно будет применяться для ревакцинации.
Что отличает вакцину от других методов борьбы с коронавирусом
Кстати, документ написан очень простым языком, очень внятно разобраны почти все вопросы, и в целом, читать его очень приятно и интересно, очень рекомендую: я сделал копию(, google doc ) своего документа.
Основные тезисы с дополнительными объяснениями из документа:
⇒ Дизайн исследования классический: рандомизированное, двойное слепое, плацебо-контролируемое. Это значит, что вакцина тестируется относительно плацебо, которое гарантированно не создает иммунитета, и что введут конкретному человеку не будет знать ни он, ни врач. Это необходимо для предотвращения влияния информированности человека на результаты: к примеру, группа порадовалась, что ввели вакцину, и дружно пошли гулять, сорвав с себя маски, и часть из них заразилась (вакцина вакциной, а большая вирусная нагрузка все равно позволит заболеть). И мы уже не можем отделить -10% положительного влияния на заболеваемость вакцины и +50% отрицательного влияния от ощущения безопасности. А если есть контрольная группа, которая получает плацебо, то вычислить становится гораздо проще — процент заболевших, получивших плацебо, это база, относительно которой считается эффективность вакцины.
⇒ Соотношение групп плацебо:вакцина составляет 1:3, т.е. вероятность получить вакцину 75%. Для чего так сделано — не знаю. Возможно, некая попытка дать тестерам больше плюсов от участия. Всего будет участвовать 500 человек, из которых 375 получат вакцину, а 125 — плацебо. Это очень маленькая группа для третьей стадии клинических испытаний, обычно они проходят на тысячах. Например, у Спутника-V третья стадия это 40 000 человек, сравните с протоколом вакцины, про которую эта статья. Вероятно, 500 это некая формальная минимальная группа для одобрения вакцины МЗ РФ для выхода на рынок. ВОЗ рекомендует использовать группу вакцинированных от 15 тысяч человек, и вакцина должна снижать заболеваемость более чем на 50%, чтобы она была признана успешной.
⇒ Вакцина уже была исследована в доклинических испытаниях на животных и первых двух стадий клинических испытаниях на людях. В доклинике это были мыши, морские свинки, хорьки и обезьяны. В клинике — 108 человек на первой стадии и 508 на второй .
Такие исследования означают, что вакцина не вызывает опасных побочек и эффективна в выработке антител.
Насколько эффективна — этот вопрос и должна проверить третья стадия. Правда, с такой группой статистика будет не очень качественной. Третью стадию на больших группах могли бы провести в Китае, но есть нюанс — там очень маленькая частота заражений, поэтому для большой разницы между контрольной и вакцинированной группой потребуется очень большие группы, гораздо больше чем десятки тысяч. Поэтому и тестируют в других странах. Например, в Пакистане эту же вакцину тестируют на 40 000 человек в группах 1:1.
⇒ Вакцина тестировалась с дозами 5х1010, 10х1010и 15х1010вирусных частиц (50 миллиардов, 100 миллиардов и 150 миллиардов соответственно), было установлено, что даже самая маленькая доза (5х1010ВЧ) создает такой же уровень антител, как и другие, но с ней процент сильных побочных эффектов значительно ниже (1% вместо 9% у 10х1010), поэтому она и была выбрана для всей третьей стадии клиники.
Надо понимать, что "иммуногенность вакцины" != "иммунитет в популяции". Вакцина может создавать иммунный ответ путем выработки антител, это проверить легко, но совсем не обязательно при этом она будет создавать иммунитет, и совсем не обязательно этот иммунитет будет создаваться у достаточного большого количества людей. Иммуногенность — это unit-тесты, которые проверяет один компонент иммунитета, процесс создания антител. А третья стадия клинических испытаний, проверка на протективность — это интеграционные тесты, которые проверяют, что в достаточной, чтобы по ней можно было судить о популяции, выборке, не только вырабатываются антитела, но и возникает иммунитет против конкретного заболевания. А причин, почему может возникать иммунный ответ, но не возникать иммунитета, множество: начиная от неправильной формы белка, антитела к которому совсем не защищают от вируса и заканчивая такой редкой штукой как ADE (антителозависимое усиление инфекции) — когда выработка антител на вакцину наоборот, ухудшает протекание болезни. Конкретно в случае SARS-CoV-2 это маловероятно, но вариантов, где что-то может пойти не так, масса.
Поэтому до окончания третьей стадии нельзя говорить о том, что вакцина создает иммунитет, только о иммуногенности.
Так что когда в информированном согласии пишут "Данные исследования показали, что вакцина Ad5-nCoV иммуногенна, т.е. способствует формированию иммунитета, обеспечивает хорошую защиту от заражения и безопасна для применения у человека", они очень сильно лукавят, приравнивая иммуногенность к иммунитету.
Каковы основные этапы испытаний вакцины на людях
Назад Вакцины против COVID-19: необходимо обеспечить равный доступ к вакцинации
Как обеспечить равный доступ к вакцинации во время текущей и будущих пандемий? Комитет Совета Европы по биоэтике сформулировал ряд рекомендаций, уделяя особое внимание людям, которые находятся в уязвимом положении и испытывают трудности в получении доступа к медицинским услугам. Во-первых, необходимо разработать стратегии, направленные на предупреждение дискриминации из-за материальных аспектов, таких как логистические и административные препятствия, расходы на вакцинацию и опасность манипулирования системой. Эти стратегии должны учитывать потребности людей, которые систематически находятся в неблагоприятном положении в плане доступа к медицинской помощи.
Кроме того, эксперты Комитета подчеркивают важность повышения уровня прозрачности, совершенствования механизма представления информации и улучшения коммуникации как инструментов укрепления доверия и обеспечения равных возможностей доступа к вакцинации для всех людей, которым рекомендовано привиться. Наконец, для обеспечения качества вакцинации требуется должный уровень безопасности и эффективности вакцин. Европейская фармакопея ( EDQM ) предоставляет международные стандарты качества для вакцин. Более того, в соответствии с Конвенцией Совета Европы МЕДИКРИМ странам-членам необходимо предупреждать фальсификацию вакцин и бороться с ней.
Конвенция о правах человека и биомедицине ( Овьедская конвенция ) ― единственный юридически обязывающий международный инструмент в этой области ― требует, чтобы страны-члены «с учетом потребностей и имеющихся ресурсов принимали необходимые меры по обеспечению равного доступа к медицинским услугам надлежащего качества». Правительства несут ответственность за управление кризисами в области здравоохранения при соблюдении прав человека и основополагающих свобод. Когда речь идет о вакцинации, это предполагает обеспечение равных возможностей всем людям, без какой-либо дискриминации, на получение безопасной и эффективной прививки. В условиях недостаточного количества вакцин необходимо установить приоритетность в отношении предоставления доступа к вакцинации, чтобы свести к минимуму число смертей и тяжелых форм заболевания, а также снизить уровень передачи инфекции. Вместе с тем необходимо, чтобы в рамках каждой группы, определенной в ходе процесса установления приоритетности, каждый человек имел возможность сделать прививку.
В своем заявлении Комитет по биоэтике поддерживает Всемирную организацию здравоохранения и другие органы в их усилиях по содействию равенству между странами и по созданию механизмов международного сотрудничества.
Пресс-релиз
Вакцины против COVID-19: необходимо обеспечить равный доступ к вакцинации
Комитет по биоэтике Страсбург 22 января 2021 г.
- Diminuer la taille du texte
- Augmenter la taille du texte
- Imprimer la page
ru-RU
- deutsch-Deutschland english-United Kingdom français-France italiano-Italia
See some examples how the ECHR promotes access to proper health care , the safeguarding of people with mental health issues , and lots more.
Каким образом будет обеспечен широкий доступ к вакцине после ее создания

Вместе с Медицинским институтом им. Березина Сергея изучаем эффективность вакцинации от COVID-19 в естественных условиях — насколько эффективны российские вакцины против тяжелого течения болезни и разных штаммов коронавируса.
Новости проекта

Журнал Respiratory Research опубликовал третье исследование эффективности вакцинации
Статья вышла 10 октября. Ученые Европейского университета и Медицинского института им. Березина Сергея (МИБС) оценили, насколько эффективно российские вакцины защищают от поражения легких во время волн COVID-19, вызванных дельтой и омикроном.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

22 сентября журнал BMC Public Health выпустил статью исследователей Европейского университета и Медицинского института им. Березина Сергея (МИБС). Ученые изучали, как российские вакцины защищают от заражения дельта-вариантом SARS-CoV-2. Согласно результатам, эффективность «Спутника V» составила 56%, «Спутника Лайт» — 49%, «ЭпиВакКороны» — -58%, «Кови Вака» — 40%.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Журнал BMC Medicine опубликовал результаты исследования эффективности вакцинации
Публикация вышла 20 сентября в BMC Medicine — ведущем журнале серии BMC. Ученые Европейского университета и Медицинского института им. Березина Сергея (МИБС) рассчитали эффективность российских вакцин в реальной практике во время третьей волны пандемии, вызванной дельта-вариантом коронавируса.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

«Спутник V» защищает от повреждения легких, вызванного штаммами дельта и омикрон
Исследователи Европейского университета и Медицинского института им. Березина Сергея (МИБС) рассчитали эффективность российских вакцин против поражения легких во время волн COVID-19, вызванных дельтой и омикроном. Эффективность двух доз «Спутника V» составила 56 %, а трех — 71 %. «ЭпиВакКорона» не показала эффективности.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

«Спутник V» защищает от дельта-варианта SARS-CoV-2: результаты независимого исследования
Исследователи Европейского университета в Санкт-Петербурге и Медицинского института им. Березина Сергея рассчитали эффективность российских вакцин против симптоматической коронавирусной инфекции во время вспышки, вызванной дельта-вариантом. «Спутник V» защищает от дельта-варианта — эффективность вакцины составила 58%. В реальности эффективность еще выше, так как на этот расчетный показатель влияет число неучтенных переболевших.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Почему жители России не хотят прививаться от COVID-19?
В августе ученые ученые Европейского университета, Медицинского института им. Березина Сергея, Первого меда в Санкт-Петербурге и Тарусской больницы опубликовали результаты независимого исследования эффективности вакцинации против COVID-19. «Коммерсантъ» опубликовал материал об исследовании «Спутника V» и основных причинах отказа от вакцинации.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Антон Барчук рассказал об исследованиях ИММИ в подкасте «Хорошая практика»
Директор Института междисциплинарных медицинских исследований Антон Барчук стал гостем подкаста «Хорошая практика». Выпуск посвящен эпидемиологическим исследованиям.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Материал по результатам препринта об исследовании эффективности вакцинации опубликован в журнале Science
В журнале Science Американской ассоциации содействия развитию науки опубликована статья о независимом исследовании эффективности вакцинации.
#Институт междисциплинарных медицинских исследований (ИММИ) #Исследования эффективности вакцинации против COVID-19

Вакцинация защищает пациентов с COVID-19 от госпитализации и тяжелого поражения легких: независимое исследование
При заражении SARS-CoV-2 людям, привитым «Спутником V», реже требуется госпитализация. Эффективность вакцинации на этом этапе составляет 81%, то есть шансы тяжелого течения COVID-19 снижаются в 5 раз.